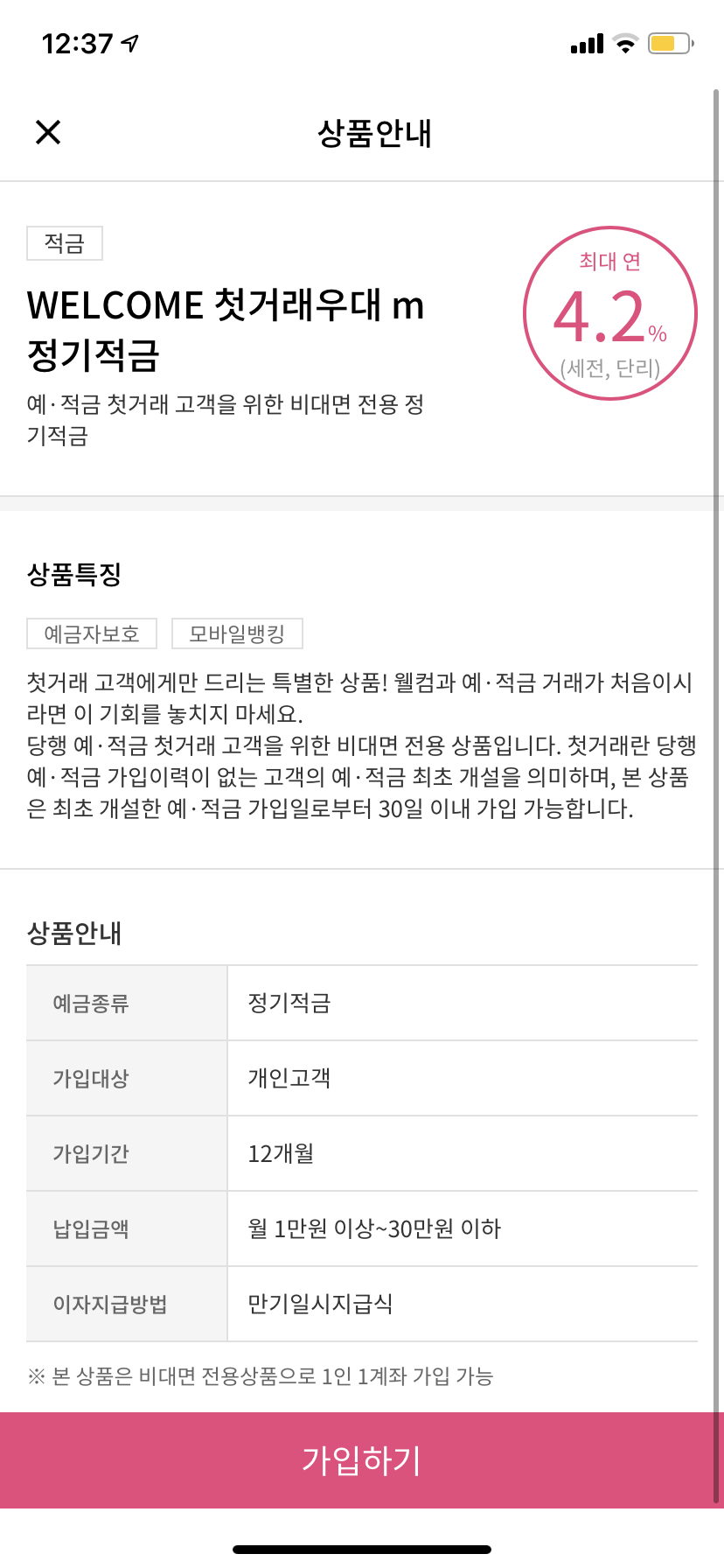
4. 기하 이성질체가 가능한 화합물은?
- (CH3)2C=CCl2
- (CH3)3CCCl3
- CH3ClC=CCH3Cl
- (CH3)ClCCCH3Cl2
답: [3]
해설:
CH3 CH3 CH3 Cl
\ / \ /
C=C C=C
/ \ / \
Cl Cl Cl CH3
[Cis 형] [Trans 형]
7. 표면분석 장치 중 1차살과 2차살 모두 전자를 이용하는 것은?
- Auger 전자 분광법
- X-선 광전자 분광법
- 이차 이온 질량 분석법
- 전자 미세 탐침 미량 분석법
답: [1]
해설: ~살 ≒ 전자 빔(electron beam)
- Auger 전자 분광법: 오제분광법이란 전자빔을 표면에 쏘면 원자의 전자 껍질 중 아래에 있는 전자가 이탈하게 되는데 이를 바깥쪽 껍질의 원자가 채우고 나서 이때 생긴 에너지가 빛으로 바뀌지 않고 또하나의 원자를 원자계로부터 이탈시키는데 쓰인다. 이렇게 떨어져나가는 전자는 오제 전자라고 부르고 이 전자의 운동에너지를 측정해서 원소를 구분하는 것이 오제 분광법의 핵심이다.
- X-선 광전자 분광법: XPS라고도 하며 X 선을 시료표면에 조사해서 나오는 광전자의 운동에너지로 원소를 구별한다.
- 이차 이온 질량 분석법: 물질에 1차 이온빔을 조사하면 여러 입자가 방출될 수 있는데 이이 중 이온화 되어 나오는 2차 이온 입자를 검출하는 방법이다.
- 전자 미세 탐침 미량 분석법: 전자 빔을 쏴서 물질에서 튕겨져 나오는 X-선의 파장장으로 원소를 구별한다.
8. Kjeldahl법에 의한 질소의 정량에서, 비료 1.325g의 시료로부터 암모니아를 증류해서 0.2030N H2SO4 50mL에 흡수시키고, 과량의 산을 0.1908N NaOH로 역적정하였더니 25.32mL가 소비되었다. 시료 속의 질소의 함량(%)은?
- 2.6
- 3.6
- 4.6
- 5.6
답: [4]
해설:
[50mL-(0.19.8N × 25.32mL ÷ 0.2030N)] × 0.2030N = 5.318944meq
1 : 1 = NH3 : N
5.318944meq × (1eq/1000meq) × 14.0067g/eq = 0.0745g
(0.0745/1.325) × 100(%) = 5.6%
12. 표준상태에서 S8 15g이 다음 반응식과 같이 완전 연소될 때 생성된 이산화황의 부피는 약 몇 L인가?
(단, 기체는 이상기체이며 S8의 분자량은 256.48g/m이다.)
S8(S) + 8O2(g) → 8SO2(g)
- 0.47
- 1.31
- 4.7
- 10.5
답: [4]
해설: 기체는 표준상태에서 1몰당 22.4L
(15 ÷ 256.48) × 22.4 × 8 = 10.5
17. 이황화탄소(CS2) 100.0g에 33.0g의 황을 녹여 만든 용액의 끓는 점이 49.2℃일 때, 황의 분자량은 몇 g/mol인가?
(단, 이황화탄소의 끓는점은 46.2℃이고, 끓는점 오름상수(Kb)는 2.35℃/m이다.)
- 161.5
- 193.5
- 226.5
- 258.5
답: [4]
해설:
△T = K × m
49.2 - 46.2 = 2.35 × m
m = 1.2766(mol/kg)
100.0g의 용매가 있으므로
1.2766 × 0.1 = 0.12766mol
33.0g ÷ 0.12766mol = 258.5g/mol
18. UV 분광광도법의 인증 표준물질로서 이상적인 조건이 아닌 것은?
- 투과율이 파장에 따라 적합하게 변화할 것
- 투과율이 온도에 관계없이 일정할 것
- 반사율이 적고 간섭 현상이 없을 것
- 형광을 내지 말 것
답: [1]
해설: 투과율이 파장에 따라 변화하면 안된다.